研究内容 - Research
私たちの体は数多くの細胞によって構成されています。私たちはもともと受精卵という1個の細胞として「誕生」し、これが分裂を繰り返し、さらにそれぞれの細胞がそれぞれ別の組織・器官となるように分化した結果、数十兆個の細胞からなる個体が作られるに至りました。
ではその過程において、細胞はどのような仕組みで分裂するのでしょうか? 体の組織はどのように作られるのでしょうか? 我々は細胞分裂と組織形成の分子メカニズムを探究することで、生命誕生の神秘に迫りたいと考えました。ここで特に、細胞の骨組みというべき「細胞骨格」(微小管・アクチン・中間径フィラメント) に着目し、細胞骨格がどのように細胞分裂と組織形成に役割を担うのかを解明すべく、研究を展開しています。
もし、細胞骨格に異常が生じると私たちに何が起きるのでしょうか? 病気や疾患症状のいくつかは、細胞骨格の異常が原因かもしれないということが近年少しずつ分かってきています。我々は細胞骨格とその関連因子と疾患の関連を追究することで、これらの疾患が発生するメカニズムに迫りたいと考えています。
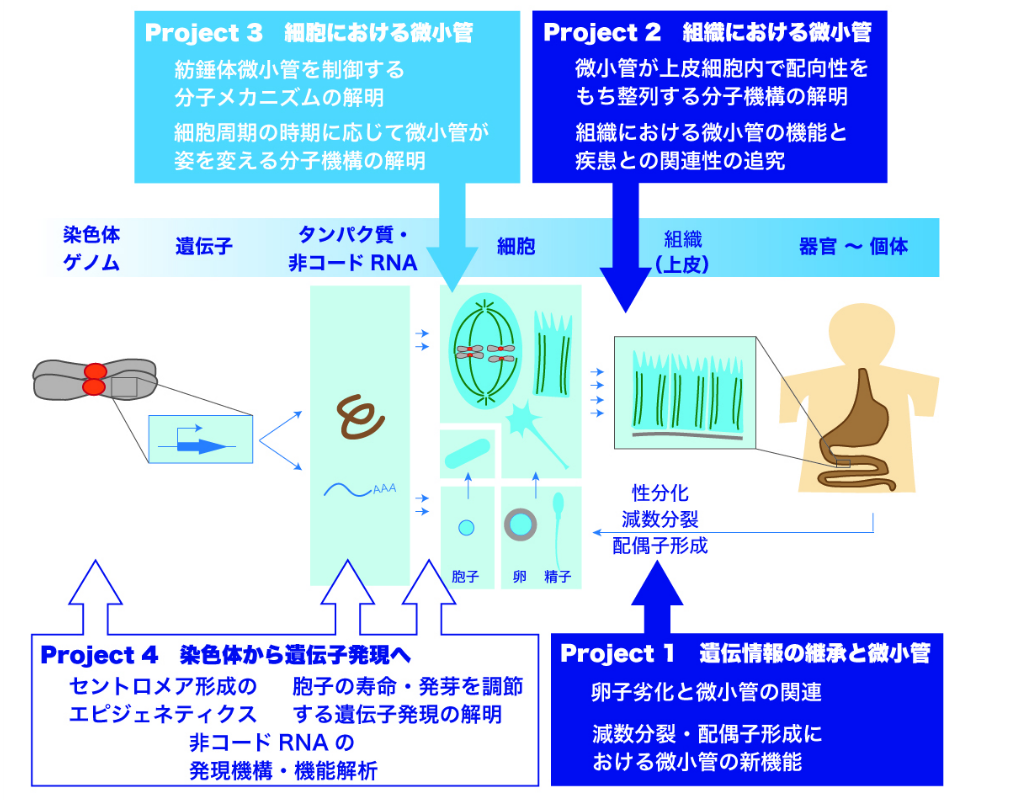
我々の研究室では、遺伝子から細胞、組織に至るいくつかのステップに注目し、それぞれについて以下のように研究プロジェクトを設定しています。
![]()
細胞の分裂には、通常の細胞増殖に利用される「体細胞分裂」と、生殖細胞 (配偶子=精子・卵、酵母では胞子) を産生するための「減数分裂」という二つの分裂様式があり、細胞のおかれた環境および条件に応じてどちらの様式に従うべきか運命が決定されます。この細胞分化は特に性分化と呼ばれます。減数分裂に欠陥があると異常な精子・卵が作られてしまい、不妊・流産や先天性染色体異常 (ダウン症候群などのトリソミー) の原因となるため、生殖医療・不妊治療の観点から近年社会的な関心を集めています。
では、体細胞分裂と減数分裂のメカニズムの違いはどこにあるのでしょうか? 減数分裂は生殖細胞を産生することに特化しており、体細胞分裂と比較して様々な構造上の違いが存在しますが、どのような遺伝子がこれらの違いを生み出すのか、この違いにはどのような生物学的重要性があるのかを探究しています。特に、染色体の動態や細胞骨格 (微小管) の機能を解明することに焦点を当てています。
![]()
これまで微小管の形成メカニズムや細胞内で果たす機能は、主に酵母や培養細胞という単一細胞を用いた研究から解明されてきました。これは、単一細胞の細胞生物学のほうが観察や実験が技術的に容易であり、さらに酵母であれば遺伝子操作などを含む遺伝学実験をおこなえるメリットがあるからです。
その一方で、私たちの体は多くの細胞が集合して組織を作っており、その中で細胞の形が決まり機能を発揮していくので、私たちの体の中における微小管の生理的な機能を追究するためには組織の中に存在する細胞の微小管構造にも着目していく必要があります。
そこで我々は、マウスの上皮組織において微小管がどのように存在しているのか、微小管はどのようにコントロールされているのか、どのような機能を担っているのかを調べます。上皮組織は、腸や腎臓、肺、肝臓など多くの臓器を構成する組織です。上皮組織はいくつもの上皮細胞によって構築され、上下 (頂端―基底軸) を保って働きます。上皮細胞の中で微小管は、この頂端―基底軸に沿って、まるで「すだれ」のような特徴的な形を示します。我々は、この上皮微小管に着目して、組織における微小管の機能を調べていきます。この研究を通して、微小管が我々の病気にどのように関係してくるのかを追究します。
![]()
Project1およびProject2でも触れたように、微小管は、細胞分裂や組織の形態形成に必要不可欠の役割を果たすことが明らかになりつつあります。すなわち、細胞内で微小管が正しく形成されることが、これらすべての始まりだといえます。それでは細胞内で微小管はどのように形成されるのでしょうか。
また、分裂していない時期の細胞では微小管は細胞質に存在しますが、分裂期になるとそれらは消失して、紡錘体と呼ばれる構造に劇的に形状を変えます。紡錘体の微小管は、複製された染色体 (姉妹染色分体) の動原体部位を結合して両側から引っ張ることで、染色体を2個の娘細胞へと分配します。染色体分配の異常は細胞のがん化と密接に関連しており、微小管は適切な時期に適切な場所に正しく紡錘体を形成して、異常のないように確実に染色体分配を遂行しなければなりません。
本プロジェクトでは、細胞周期の時期に応じて微小管がその姿を劇的に変化させていく分子メカニズムを解明することを目指し、主に分裂酵母とヒト培養細胞を用いて、遺伝学的・細胞生物学的アプローチに基づく探究を続けています。
![]()
細胞が分裂して生き続けるのは何故でしょうか? もちろんこの大きな問いに答えを出すのは容易ではありません。でも例えば、細胞が1個から2個に分裂して増殖する際に、細胞がもっている染色体 (ゲノム) を複製し、紡錘体微小管によって2組に分配することの重要性は既にProject3でみた通りです。ここで、微小管のみならず、染色体の動原体部位が正しく作られていないと、微小管が正しく結合できず、分配異常に陥ります。動原体は、1本の染色体につき1個のみ存在しなければならず、0個でも2個以上でも染色体の分配異常に至るため、染色体が複製されて細胞が新しく作られる際に、必ず1染色体に1個のみ動原体を作る仕組みが明確に確立しているといえます。
その鍵となるのは、染色体DNAに巻き付くヌクレオソームの構成成分であるヒストン8量体のなかのヒストンH3タンパク質です。ヒストンH3のなかにはセントロメア領域にのみ存在する特別な種類のヒストンH3 (いわゆるヒストンH3バリアント) として知られるCENP-Aタンパク質があり、これが動原体の形成に欠かせません。CENP-Aが染色体のセントロメア領域に結合することによって、そこが動原体を形成する場所だということが決まります。
では、CENP-Aがどのようにして染色体のセントロメアのところだけに呼び込まれるのでしょうか。もちろんセントロメアのDNA配列が重要であることは言うまでもありませんが、必ずしも塩基配列だけで決まるわけではありません。幾度となく染色体が複製されて細胞が分裂を繰り返しても、CENP-Aがセントロメア領域に呼び込まれるという現象は世代を超えて受け継がれていく (エピジェネティックに維持されていく) メカニズムには、いまだ不明な点が多く残ります。本プロジェクトでは、CENP-Aがどのように制御されることで染色体に動原体構造を作っていくのかに迫ります。
関連して、真核細胞の染色体上に存在する遺伝子のなかには、タンパク質をコードしない非コードRNA(ncRNA)の遺伝子が多数存在することが明らかになっています。これらのncRNAの機能は大部分が明らかになっておらず、本研究ではその解明を目指しています。
また先の大きな問いに対して別の見方をすれば、細胞の寿命がどのようにきまるのかも細胞生物分野に残された大きな難問のひとつです。細胞は分裂していない静止期において、長い時間「生存」を保つことができます。細胞はその後、再び分裂サイクルに戻すこともできます。このような細胞周期の静止・再稼働はどのような遺伝子によってコントロールされるのでしょうか?
最近、我々は細胞が休眠から目覚める機構を解明しようと研究を進めています。これまでの解析結果から、ヒストンH3をコードする遺伝子が細胞の効果的な目覚めに役割を果たすことがわかりました。
早稲田大学 先進理工学部 生命医科学科
教授 佐藤 政充
国際理工学センター 准教授 戸谷 美夏
